《黄帝内经》所说:“上工治未病,不治已病,此之谓也”。“治未病”即采取相应的措施,防止疾病的发生发展。预防疾病所花费的代价远远小于治疗的,对于慢性病也是如此,我们提倡尽早预防疾病,在早期干预。糖尿病严重危害人类健康,过去对糖尿病的治疗,常用的是对症治疗,通过胰岛素来控制血糖的增高,缓解糖尿病引起的各种并发症。而如今通过膳食干预,调整人体代谢平衡来预防疾病发生已成行业热点。那还有其他措施进行干预吗?今年,浙江大学黄荷凤院士与中国科学院徐国良院士,从生命早期找到糖尿病的起源,揭示了糖尿病新的遗传方式,相关成果已刊发2022年《自然》顶级期刊。

提出问题。黄荷凤院士带领团队致力于开展母体不良环境因素导致的子代成人疾病研究,团队发现高糖/高雄激素等不良因素暴露,能够通过改变宫内胚胎/胎儿DNA甲基化谱式,或者通过影响精子/卵子表观修饰,而引起慢性疾病的代间/代际遗传(子代由卵细胞和精子结合成受精卵发育而来)。结合临床流行病学调查和动物模型的研究成果,她认为糖尿病和高血压这些成年的慢性疾病都存在发育起源性。
验证猜想。为了验证她的想法,她带领团队建立了雌性小鼠糖尿病模型。探索母亲高血糖是否能通过卵母细胞增加子代慢性疾病的风险。为了排除高血糖对胚胎和胎儿发育的持续影响,研究者巧妙的将受影响的卵母细胞取出进行体外受精和胚胎移植,由健康雌鼠代为孕育和哺育。结果显示子代小鼠糖耐量受损(餐后血糖升高大于正常标准)。这些结果说明卵母细胞受到高血糖不良环境的影响,容易患上糖尿病。
思考原因。研究团队试图找到什么是增加子代糖尿病易感性的“元凶”?对高血糖小鼠的卵母细胞进行转录组分析等试验,发现受高糖影响的卵母细胞中DNA去甲基化酶TET3表达,明显受到抑制,跟正常的细胞相比,受高糖影响的卵母细胞中的TET3酶含量少。
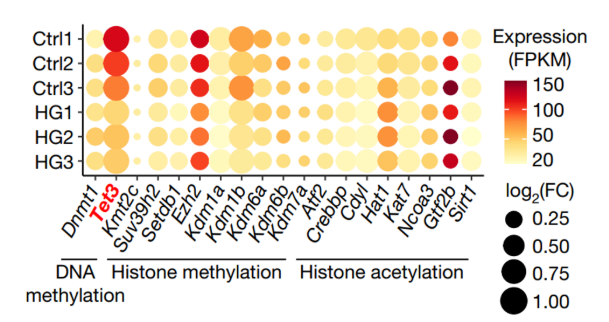
转录组分析:DNA去甲基化酶TET3在HG(高糖)组中表达很低
分析机制。虽然找到最终源头的可能是DNA去甲基化酶TET3,那它究竟在子代个体发育过程中扮演什么角色呢?试验结果表明,由于糖尿病雌鼠体内的高糖环境,让卵母细胞中具有重编程DNA甲基化谱式功能的TET3蛋白量不足,进而使得TET3在受精后进入雄原核中推动重编程的潜能不足,导致“高甲基化”,影响了精子DNA组原有的甲基化重编程模式,包括葡萄糖激酶Gck等一系列胰岛素分泌基因的启动子呈现高甲基化状态,持续存在于子代的胰岛上,从而导致胰岛素分泌不足,胰岛素分泌不足导致身体无法快速储存和利用葡萄糖,导致餐后血糖升高,成年小鼠糖耐量受损,特别是在子代高脂饮食的诱导下更容易诱发糖尿病的发生。
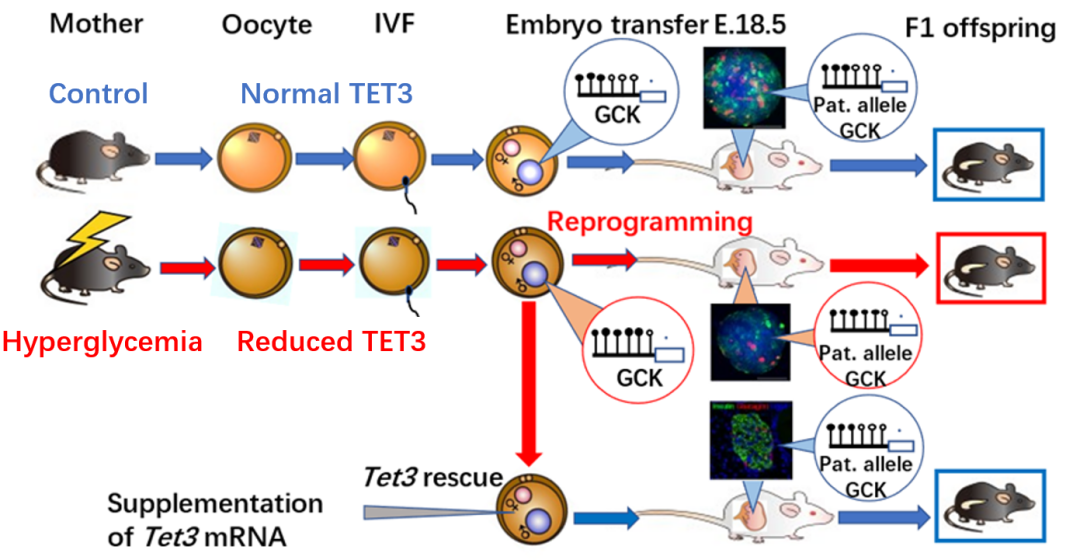
通过补充Tet3 mRNA,恢复TET3表达,可使后代小鼠恢复正常
这项研究的重大意义在于,不仅建立了高血糖通过卵母细胞对子代表观基因组产生不利影响与后代易患代谢紊乱疾病之间的联系,还揭示了潜在的机制,同时解释了双亲都没有糖尿病的情况下,后代却容易患上糖尿病的现象。对科研工作者来说,为探索预防各种慢性病,提供一个新思路。最后,也提醒我们,在怀孕生育阶段,需要身体处于健康状态,否则可能会对后代的健康造成不良影响。

参考部分图文来源于:《Nature》、浙大融媒体中心



